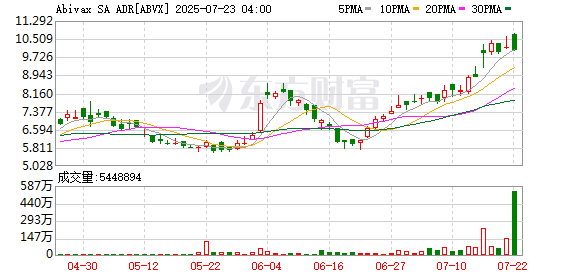
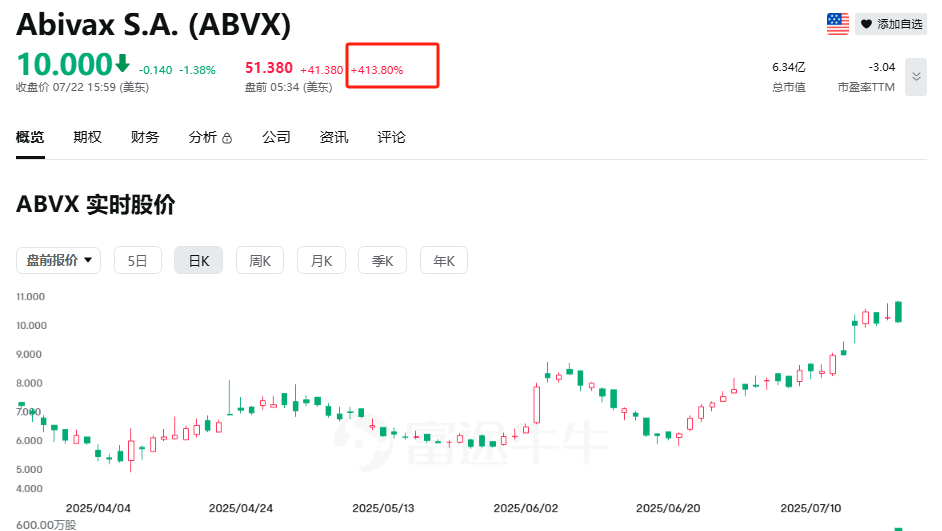
美股创新药板块有望冲出一匹黑马。7月23日,市值6.34亿美元的法国胃肠道药物开发商Abivax美股盘前暴涨超400%。
该公司此前公布了其核心药物、口服小分子药obefazimod针对中重度活动性溃疡性结肠炎(UC)的III期ABTECT-1和ABTECT-2试验的积极诱导期结果——
疗效显著:50mg剂量的obefazimod在合并分析中实现了16.4%的安慰剂校正临床缓解率,具有高度统计学显著性和临床意义。
安全性良好:未观察到新的安全信号,治疗普遍耐受性良好。
Abivax是一家专注于慢性炎症疾病的法国生物技术公司,总部位于巴黎,2013年成立,2023年在纳斯达克上市,成为法国上市生物技术公司有史以来最大的美国IPO(募资总额为2.36亿美元)。
该公司目前只有一个处于临床试验阶段的研发药物,即Obefazimod,但是目前正在开发其针对多个适应症,且在寻机扩大公司的研发管线。
Obefazimod的临床试验需要入组上千人、跟踪两年。该项目在2025年第二季度完成患者招募,如今第三季度较早时候即公布诱导期结果。
炎症是具有血管系统的活体组织对损伤因子发生的防御性反应,可以清除进入机体的有害物质,但有些时候却对机体自身发生反应而造成损伤。目前对于炎症性肠病(IBD)的治疗主要是生物制剂如IL23单抗等等,但是也有口服药物如S1P抑制剂、JAK1抑制剂等等。
Obefazimod是一款口服小分子同类首创药物,通过增强miR-124表达发挥抗炎作用,miR-124是一种在大脑皮层和小脑中特异性表达最丰富的miRNA,该靶点的分布范围广,是炎症反应的天然调节因子。这意味着Obefazimod可被开发用于治疗多种炎症性疾病(如溃疡性结肠炎、克罗恩病、类风湿性关节炎)和多种病毒性疾病(COVID-19、HIV)。Obefazimod最初便是针对艾滋病研发,后转向UC治疗,且计划开展克罗恩病等适应症研究。
2023年6月份,Abivax递交的obefazimod临床试验申请获CDE受理。不过,药物正式获批上市前,Abivaxs是否能凭借单一候选药物冲出重围仍未可知。该公司员工数目大概是70人,每年仍面临着巨额亏损,2024年现金余额1.442亿欧元,只能支持运营至2025年第四季度。就药物本身而言,obefazimod存在30%到40%的头痛副作用,14%的停药比例,远远高于安慰剂8%的水平。
IBD具有复发、缓解交替特点,患者常出现黏膜损伤、肠腔狭窄、瘘管、肛周病变等并发症,最终仍有相当比例患者需接受手术干预,疾病负担沉重。现有IBD治疗药物存在未满足需求,起效慢、缓解深度有限,且对部分人群无效,部分患者存在抗药性或副作用耐受性差等问题;IBD治疗目标由“临床缓解”逐步提升至“内镜/组织学愈合”,进一步要求治疗方案实现更深层次的炎症控制。
全球IBD药物市场规模超200亿美元。根据Evaluate Pharma,2022年全球IBD市场空间规模为230亿美元,预计2028年将达到280亿美元;一线生物制剂中TNFi及Ustekinumab已专利到期,Risankizumab IBD适应症销售快速增长,Guselkumab UC/CD适应症获批有望贡献销售增量,Vedolizumab2024年UC/CD适应症合计贡献~60亿美元,预计将于2030年前专利到期。
国信证券表示,IBD治疗领域存在未满足的需求,建议关注国内IBD治疗新靶点、双抗等潜在出海机会。
国内IBD 研发管线覆盖生物类似药、小分子抑制剂及干细胞疗法三大方向。财通证券表示,本土药企从跟随到并跑,聚焦临床价值兑现,其中恒瑞艾玛昔替尼(UC 缓解率24.4%)、信达IL-23 单抗等通过差异化设计构建竞争壁垒。随着医保谈判向临床获益倾斜,具备显著疗效优势(如TH-SC01 瘘管闭合能力)或机制突破性(TL1A 靶点)的品种将优先获得支付支持,推动本土企业从成本竞争转向价值竞争,逐步参与全球创新分工。
(文章来源:财联社)
文章来源于网络,不代表澐甲财经立场,版权归原发布者所有https://789877.com/8325/
